骨粗鬆症治療のUnmet Medical Needs(UMN)とイベニティ
イベニティの安全性
「効能又は効果」「用法及び用量」「警告・禁忌」等その他の項目の詳細につきましては、電子化された添付文書をご参照ください。
イベニティの副作用
骨粗鬆症患者を対象とした主要なプラセボ対照国際共同第Ⅲ相試験(FRAME試験、BRIDGE試験)でイベニティの投与を受けた3,744例中615例(16.4%)に臨床検査値異常を含む副作用が認められました。主な副作用は、関節痛(1.9%)、注射部位疼痛(1.3%)、注射部位紅斑(1.1%)、鼻咽頭炎(1.0%)でした。(承認時)
重大な副作用として、低カルシウム血症(QT延長、痙攣、テタニー、しびれ、失見当識等)、顎骨壊死・顎骨骨髄炎、大腿骨転子下および近位大腿骨骨幹部の非定型骨折があらわれることがあります。
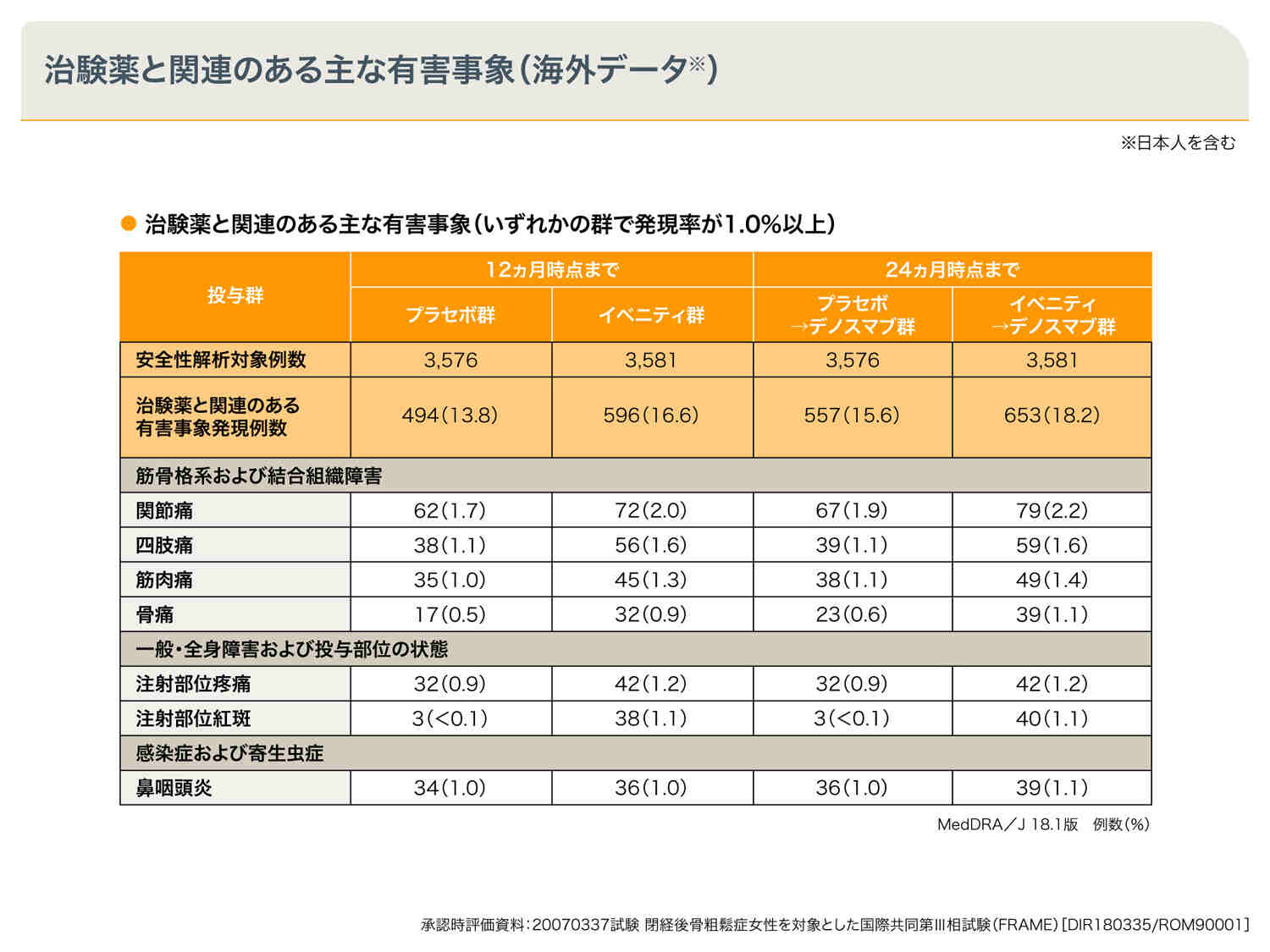
国際多施設共同第Ⅲ相臨床試験(FRAME試験、海外データ:日本人を含む)1)
日本人492例を含む7,180例の閉経後骨粗鬆症患者が登録され、実施した国際多施設共同第Ⅲ相臨床試験(FRAME試験)において、治験薬と関連のある有害事象発現率は、12ヵ月時点ではプラセボ群13.8%、イベニティ群16.6%、24ヵ月時点ではプラセボ→デノスマブ群15.6%、イベニティ→デノスマブ群18.2%であり、均衡していました。イベニティ群でみられた治験薬と関連のある主な有害事象は、関節痛、四肢痛、筋肉痛、注射部位疼痛、注射部位紅斑などでした。
また、イベニティを投与した患者さんにおいて、12ヵ月間の二重盲検期に顎骨壊死と非定型大腿骨骨折が各1例認められました。顎骨壊死の1例は不適合義歯の継続使用が原因と考えられました。
試験方法などは「イベニティの臨床効果-FRAME試験-」を参照
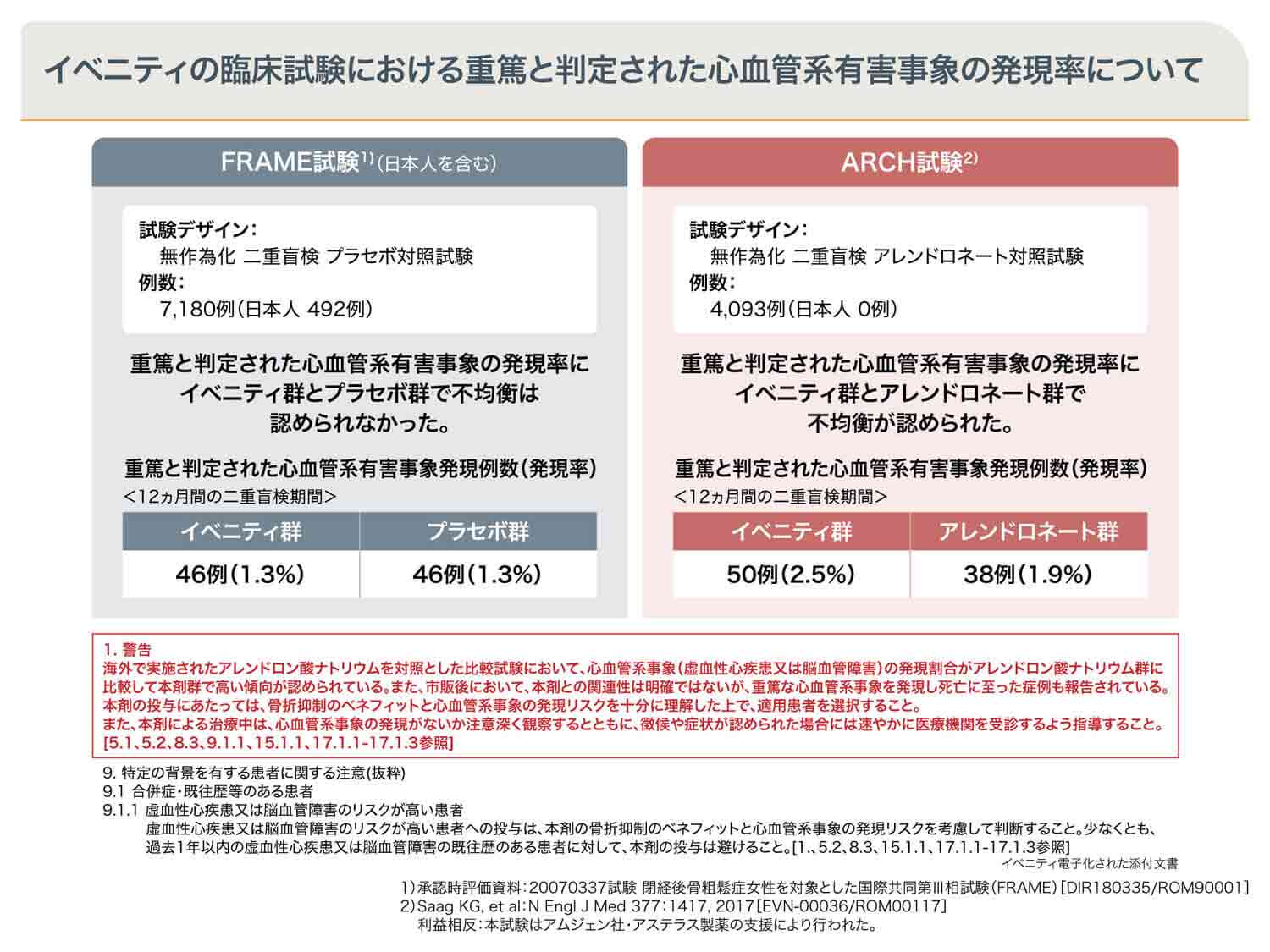
心血管系有害事象に関する検討
日本人492例を含む7,180例の閉経後骨粗鬆症患者が登録され、実施した国際多施設共同第Ⅲ相臨床試験(FRAME試験)において、イベニティ群とプラセボ群で重篤と判定された心血管系有害事象の発現率に不均衡は認められませんでした1)。
一方、日本人を含まない4,093例の閉経後骨粗鬆症患者が登録され、実施した国際多施設共同第Ⅲ相臨床試験(ARCH試験)において、イベニティ群とアレンドロネート群で重篤と判定された心血管系有害事象の発現率に不均衡が認められました2)。
また、市販後において、イベニティとの関連性は明確ではありませんが、重篤と判定された心血管系事象を発現し死亡に至った患者さんも報告されていることなども踏まえて、2019年9月の添付文書の改訂で警告を新設しました。
イベニティの骨折抑制のベネフィットと心血管系事象の発現リスクを十分にご理解いただいた上で、適用患者を選択いただき、少なくとも、過去1年以内の虚血性心疾患または脳血管障害の既往歴のある患者さんに対してはイベニティの投与は避けてください。
また、イベニティによる治療中は、心血管系事象の発現を注意深く観察し、徴候や症状が認められた場合には、速やかに医療機関を受診するよう患者さんへご指導ください。
【イベニティの承認された効能又は効果】骨折の危険性の高い骨粗鬆症
1) 承認時評価資料:20070337試験 閉経後骨粗鬆症女性を対象とした国際共同第III相試験(FRAME)[DIR180335/ROM90001]
2)
Saag KG, et al:N Engl J Med 377:1417, 2017[EVN-00036/ROM00117]
利益相反:本試験はアムジェン社・アステラス製薬の支援により行われた。



 でログイン
でログイン
